Маслянокислое брожение
|
|
|
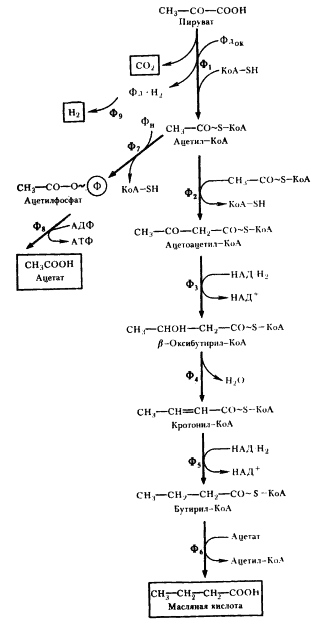
Рис. 57. Пути превращения пирувата в маслянокислом брожении, осуществляемом Clostridium butyricum: Ф1 — пируват:ферредоксиноксидоредуктаза; Ф2 — ацетил-КоА-трансфераза (тиолаза); Ф3 — (3-оксибутирил-КоА-дегидрогеназа; Ф4 — кротоназа; Ф5 — бутирил-КоА-дегидрогеназа; Ф6 — КоА-трансфераза; Ф7 — фосфотрансацетилаза; Ф8 — ацетаткиназа; Ф9 — гидрогеназа; Фдок — окисленный; Фд-H2 — восстановленный ферредоксин; ФН — неорганический фосфат |
Следующий вариант решения донор-акцепторной проблемы на базе гликолитически образованного пирувата представляет собой маслянокислое брожение. Новое в маслянокислом брожении — возникновение реакций конденсации типа С2 + С2 ® С4, в результате чего образуется С4-акцепторная кислота. Судьба этой кислоты различна и определяется необходимостью акцептирования водорода с НАД-H2, освобождающегося в процессе брожения, а это в свою очередь тесно связано с оттоком водорода на конструктивные процессы. В качестве конечных C4-продуктов в процессе брожения возникают соединения различной степени восстановленности. Характерным C4-продуктом брожения является масляная кислота. Осуществляют такой тип брожения многие бактерии, относящиеся к роду Clostridium.
Типичными представителями клостридиев, осуществляющих маслянокислое брожение, являются C. butyricum и C. pasteurianum. Они сбраживают сахара с образованием масляной и уксусной кислот, CO2 и H2 (рис. 57). Превращение глюкозы до пирувата осуществляется по гликолитическому пути. Следующая реакция — разложение пирувата до ацетил-КоА и CO2, сопровождающееся образованием восстановленного ферредоксина (Фд). Реакция катализируется ферментом пируват: ферредоксиноксидоредуктазой и является ключевой в маслянокислом брожении. Особенности реакции — участие в ней белков, содержащих негемовое железо и кислотолабильную серу (FeS-белки)45.
К FeS-белкам относится группа белков, участвующих в процессах электронного транспорта (ферредоксины), и ряд ферментов, катализирующих окислительно-восстановительные реакции. Установлено, что FeS-белки являются ключевыми в таких важных клеточных процессах, как фотосинтез, дыхание, азотфиксация, фиксация CO2.
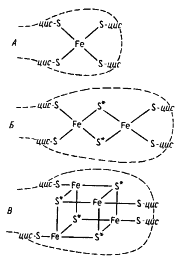
Отличительная особенность FeS-белков — строение их активного центра, содержащего негемовое железо, связанное нековалентными связями с кислотолабильной серой и серой, входящей в состав цистеиновых остатков пептидной цепи. Разные типы железосероцентров (FeS-центры) широко распространены в клетках. Простейший из них содержит один атом железа, нековалентно связанного в молекуле белка, получившего название рубредоксина, с четырьмя остатками цистеина (рис. 58, А)
|
|
|
Рис. 58. Железосероцентры FeS-белков. Железосероцентр рубредоксина (А); предполагаемые модели железосероцентров Fe2S2-типа (Б) и Fe4S4-типа (В). Звездочкой отмечена неорганическая кислотолабильная сера; прерывистой линией обозначена полипептидная цепь; цис — цистеин |
Обнаруженный у C. pasteurianum рубредоксин имеет окислительно-восстановительный потенциал около — 57 мВ и участвует в реакциях одноэлектронного переноса, в основе которого лежит переход железа:
Fe2+ « Fe3+.
Остальные FeS-белки имеют более сложно организованные FeS-центры, в состав которых входит также неорганическая кислотолабильная сера. Известны Fe2S2-центры (содержат по два атома железа и неорганической серы), Fe3S3- и Fe4S4-центры (рис. 58, Б, В). FeS-белки могут содержать один или более центров в молекуле. У большинства FeS-содержащих ферментов помимо FeS-центров в молекуле имеются и иные кофакторы: металлы (молибден, селен), хромофорные группы (флавин, гемы, птеридины), витамины (табл. 16).
Клостридии содержат ферредоксины с 1 — 2 центрами Fe4S4-типа и молекулярной массой 6000 — 7000 Да.
В зависимости от особенностей строения FeS-центров ферредоксины могут осуществлять одновременный перенос одного или двух электронов. Окислительно-восстановительный потенциал ферредоксинов находится в диапазоне от — 490 до — 310 мВ, однако описаны FeS-белки, окислительно-восстановительный потенциал которых высоко положителен (около + 350 мВ).
Ферредоксины играют центральную роль в метаболизме клостридиев, сопрягая катаболические процессы с биосинтетическими реакциями (рис. 59).
Таблица 16. Железосеросодержащие ферменты эубактерий
|
Простетическая группа |
Ферменты |
|
FeS-центры |
гидрогеназа и др. |
|
FeS-центры + тиаминпирофосфат |
пируват:ферредоксин-оксидоредуктаза |
|
FeS-центры + флавин |
сукцинатдегидрогеназа, НАД(Ф)-H2-дегидрогеназа, глутаматсинтетаза и др. |
|
FeS-центры + гем |
диссимиляционная сульфитредуктаза |
|
FeS-центры + молибден |
нитрогеназа, диссимиляционная нитратредуктаза, формиатдегидрогеназа и др. |
|
FeS-центры + два и более дополнительных кофактора |
ассимиляционная сульфитредуктаза, ксантиндегидрогеназа и др. |
Дополнительно
Эволюция и самоорганизация химических систем. Макромолекулы и зарождение органической жизни
Понятие самоорганизация означает упорядоченность
существования материальных динамических, то есть качественно изменяющихся
систем. Оно отражает особенности существования таких систем, которые
сопровождаются их восхождением на все более высокие уровни сложности и
системной упорядоченности или матер ...
Детские дошкольные учреждения – сады-ясли
Двадцатое столетие для
рядя стран Европы характерно процессами интенсивной урбанизации в связи с
индустриализацией производства и соответствующим размахом градостроительной
деятельности.
В нашей стране процесс
урбанизации привел к исключительно острой проблеме обеспечения жилищем и
общественны ...